Con IA y modernos equipos, en el INEN identifican alteraciones genéticas que explicarían el desarrollo del cáncer
Por: María Fernández Arribasplata
¿Es posible predecir si las personas van a desarrollar cáncer? Sí, para ello existen las pruebas genéticas donde se analiza el ADN de los pacientes con el fin de identificar alteraciones genéticas que puedan explicar el desarrollo del cáncer. Actualmente, el Instituto Nacional de Enfermedades Neoplásicas (INEN) cuenta con tecnología avanzada que permite predecir con mayor precisión el riesgo de desarrollar esta mortal enfermedad en personas sanas, brindándoles estrategias de prevención e incluso personalización del tratamiento.
“Nosotros al analizar el ADN somos capaces de leer, interpretar y poder predecir si las personas van a tener cáncer y plantear estrategias para evitar la enfermedad y la muerte por cáncer», señala a la Agencia Andina, el doctor Yaser Sullcahuamán, jefe del Equipo Funcional de Genética y Biología Molecular del INEN.

Esta unidad se formó hace 16 años y actualmente cuenta con 30 profesionales de la salud, entre médicos genetistas y biólogos. Todos ellos buscan saber por qué razón una persona tiene cáncer. Existen dos causas: hereditarias y ambientales.
“Cuando decimos que es hereditario, significa que en el código de la vida, en nuestro código genético, hay una alteración y esa alteración hace que ese código no funcione como debería. Por ejemplo, normalmente nuestro código hace que yo tenga cinco dedos, pero si hay una falla en el código genético hace que presente una malformación o en el caso del cáncer hace que nosotros presentemos esta enfermedad”, explica el médico genetista, quien además señala que de 10 personas, 1 ó 2 presentan alteraciones genéticas.
Código de la vida
Este código genético está compuesto por cuatro «letras»: T, G, C y A. Al igual que en el lenguaje castellano las letras forman palabras con significados específicos, la secuencia de estas cuatro letras en el ADN constituye las «órdenes» que determinan cómo somos.
“Una mutación, o un cambio en una de estas letras, puede alterar estas órdenes y llevar al desarrollo de enfermedades como el cáncer. Por ejemplo, un cambio de una guanina (G) normal a una adenina (A) en una posición específica puede ser la causa de un cáncer de tiroides en un paciente. Esta alteración genética significa que el código no corresponde con lo normal”, detalla el especialista del INEN.
Una vez identificada una mutación en el paciente, se accede a bases de datos con inteligencia artificial para comprender su significado y sus posibles efectos. Estas bases de datos contienen información a nivel mundial sobre las funciones de los genes.
“Por ejemplo, se puede descubrir que un gen con una mutación tiene la función de reparar el ADN. Si esta reparación no se lleva a cabo correctamente debido a la mutación, aumenta significativamente el riesgo de desarrollar cáncer. Mientras que la población general puede tener un riesgo de cáncer del 1% al 5%, una persona con una mutación en un gen de reparación del ADN podría tener un riesgo del 90% al 99%”, explica.

Al identificar la mutación específica que causa el cáncer, se pueden utilizar tratamientos que ataquen precisamente a las células con esa alteración, a esto se le denomina medicina de precisión, un enfoque avanzado donde el tratamiento se personaliza según las características genéticas del tumor. Incluso, el reporte genético puede indicar si un paciente responderá o no a un tratamiento específico.
“Este conocimiento permite adelantarse a la enfermedad. En lugar de esperar a que el cáncer se manifieste, se puede predecir el tipo de cáncer al que la persona tiene mayor predisposición. Esto posibilita implementar estrategias de vigilancia temprana y medidas preventivas antes de que la enfermedad se desarrolle”, enfatiza Sullcahuamán.
¿Quiénes pueden realizarse las pruebas genéticas?
Todos los pacientes que acuden al INEN con diagnóstico de cáncer pueden ser derivados al área de genética. Sin embargo, hay requisitos que se deben cumplir: ser menores de 50 años, con dos tumores o con antecedentes familiares de cáncer.
Este grupo de pacientes pueden pasar por una consulta de genética donde se evalúan los patrones de herencia familiar, se realiza un examen físico y se decide si es necesario realizar un estudio de ADN para determinar si el cáncer tiene un origen hereditario.
Una parte crucial del trabajo del área genética del INEN, explica el doctor Yaser Sullcahuamán, es realizar estudios predictivos en familiares sanos (hijos, hermanos, padres) de pacientes con alteraciones genéticas identificadas.
“El objetivo es determinar quiénes han heredado la alteración y, por lo tanto, tienen un mayor riesgo de desarrollar cáncer. Al nosotros poder leer el código de la vida, es decir el material genético, podemos saber cuál es la causa de la enfermedad y por lo tanto podemos hacer los estudios de manera predictiva», señala el doctor genetista del INEN.
Es decir, agrega el especialista, si los hijos tienen la alteración estando ellos sanos, existe una probabilidad del 60, 80 ó 99% de que hagan cáncer y la idea es evitar que ellos hagan cáncer. Una vez que establecemos quiénes han heredado – mediante un test genético dirigido para la alteración genética que hemos detectado- el siguiente paso son las estrategias de prevención.
Entre las estrategias de prevención específicas, se incluyen vigilancia de órganos específicos por ejemplo en: tiroides, mama, ovario, próstata, colon, etc e intervenciones quirúrgicas preventivas. Asimismo, enfatiza Yaser Sullcahuamán, antes y después del estudio genético, se ofrece asesoramiento genético para que el paciente comprenda el significado de los resultados y pueda tomar decisiones informadas sobre su salud.
Actualmente, el INEN realiza estudios genéticos en aproximadamente 1000 pacientes por año y atiende alrededor de 4000 consultas de genética, incluyendo pacientes nuevos y en seguimiento.
¿Cómo se realiza el estudio genético?
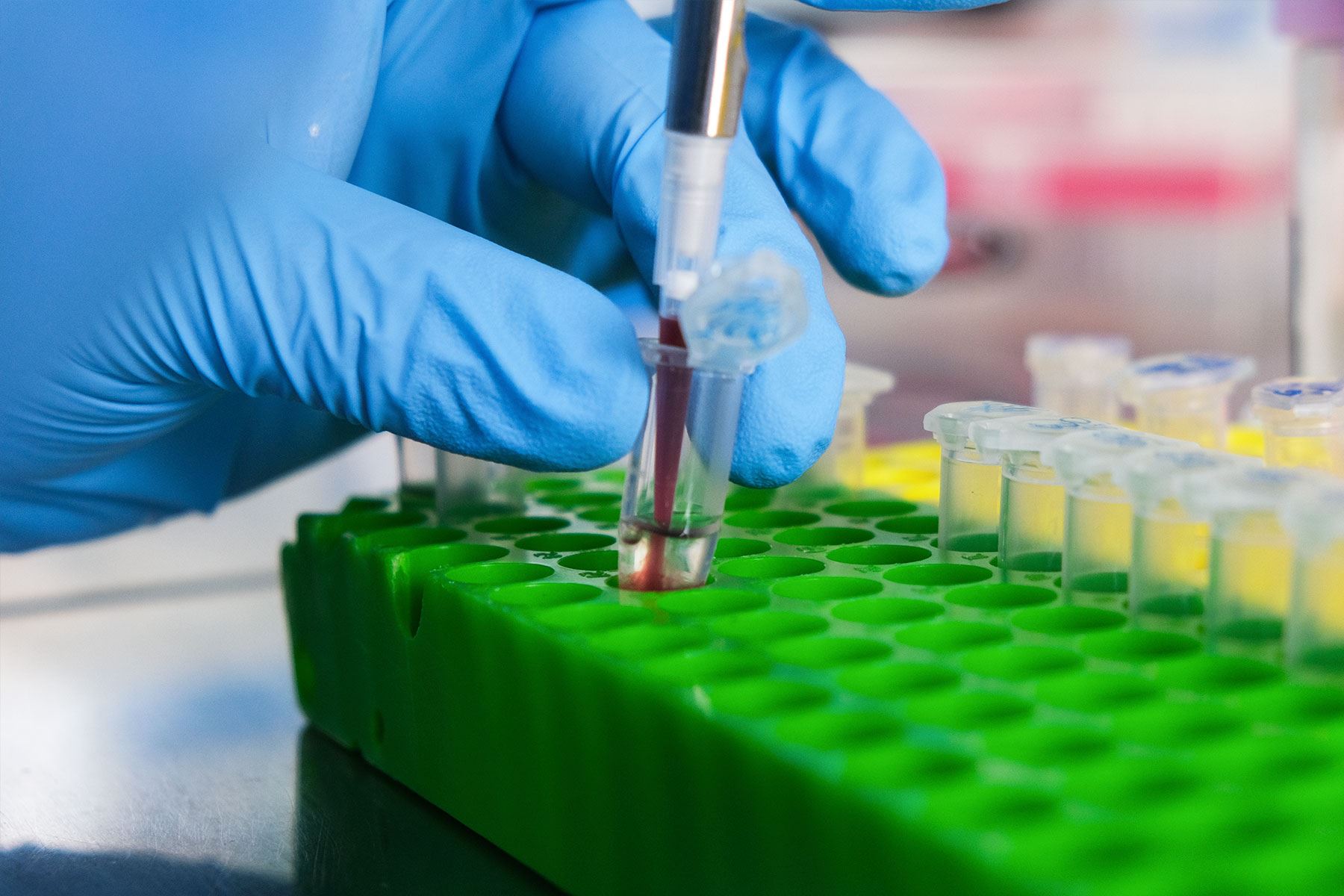
El proceso comienza con la toma de una muestra de sangre del paciente. El siguiente paso es hacer la extracción del material genético, específicamente de las zonas que están relacionadas con el cáncer.
“Se estudian 165 genes relacionados con el cáncer de los 20,000 existentes. La siguiente etapa es hacer la mezcla de los reactivos que nos permitan ser específicos con el ADN y los genes a analizar. Una vez que se da esta reacción química específica, la muestra se procesa en un equipo de Secuenciación de Nueva Generación (NGS) capaz de analizar entre 750,000 y 1 millón de pares de bases del código genético por paciente. El objetivo es identificar una alteración genética patogénica que explique el cáncer hereditario”, detalla el galeno.
La información obtenida se carga en una base de datos y se realiza un primer tamizaje de las variantes detectadas. La etapa final es la elaboración del informe que incluye el diagnóstico definitivo (si es hereditario o no), la explicación de por qué se considera hereditario y las recomendaciones para el manejo del paciente.
Análisis avanzado del ADN gracias a la tecnología

Actualmente los especialistas del INEN pueden realizar una secuenciación completa del genoma gracias al equipo de Secuenciación de Nueva Generación (NGS) con el que cuentan desde febrero de este año. Antes solo se podían analizar regiones limitadas del ADN (aproximadamente 300 pares de bases), mientras que ahora se analiza una cantidad masiva de información, entre 750,000 y 1 millón de pares de bases del código genético por paciente.
“Una vez que nosotros tenemos la información de su código, ya lo podemos revisar en una computadora, pero resulta que como humanos no podemos leer 750,000 pares de bases. Eso no es posible. Desde hace 2 años contamos con el apoyo de la inteligencia artificial, de hecho, la IA es un criterio de los cuatro que empleamos para decir si una variante es patogénica o no. Los otros criterios incluyen la historia clínica del paciente, estudios funcionales y estudios epidemiológicos”, señaló.
Como bien señala el médico genetista, la tecnología actual permite predecir con mayor precisión el riesgo de desarrollar cáncer en personas sanas que han heredado una alteración genética, lo que era impensable hace unos años.
“La principal capacidad de esta tecnología es realizar el estudio completo del genoma a partir de muestras biológicas como la sangre, permitiendo transformar la información genética en códigos computacionales y analizar una gran cantidad de secuencias de ADN por paciente, superando las limitaciones de métodos anteriores como las pruebas de PCR”, explica.
Esta avanzada tecnología es crucial porque aumenta significativamente la precisión de los diagnósticos, facilita la comprensión de enfermedades genéticas como el cáncer (incluyendo la identificación de predisposiciones hereditarias), y abre la puerta a tratamientos más personalizados.
Esta información es fundamental para que el oncólogo pueda decidir el tratamiento más efectivo para cada paciente, incluyendo terapias dirigidas, terapias biológicas, quimioterapia, radioterapia o trasplante de médula, lo que se conoce como medicina de precisión.
El doctor Yaser Sullcahuamán enfatiza que es importante contar con este equipo porque cuanto más leamos y revisemos el código genético de un paciente, aumenta nuestra probabilidad de hacer diagnósticos de precisión.
“Si nosotros podemos leer el código de la vida completo, probablemente nosotros vamos a descubrir más enfermedades genéticas y una mayor opción de explicar y de tratar la enfermedad directamente por cómo es. Nosotros al inicio íbamos a ciegas, pero ahora ya sabemos que este equipo nos da la información para saber por qué una persona ha presentado cáncer, por qué a temprana edad y también puede predecir si sus hermanos o sus hijos van a desarrollar esta enfermedad”, señala.
Sin embargo, a pesar de la disponibilidad de tecnología, el recurso humano altamente capacitado es fundamental para la interpretación de los resultados genéticos. En el país, se cuenta con aproximadamente 30 médicos genetistas. Se requiere formación en genética clínica, bioinformática y habilidades de comunicación para transmitir la información a los pacientes y sus familias.
“Discriminar entre quién tiene una enfermedad genética y quién no es el rol fundamental del médico genetista. Y aquí es necesario un entrenamiento en genética clínica, es necesario un entrenamiento en bioinformática, en lenguajes de programación y sobre todo la capacidad de entender y aprender a comunicar esta información al paciente y su familia”, señala.
Descentralización y pruebas gratuitas para pacientes con SIS

Las pruebas genéticas están disponibles en algunos centros del país y muchas de ellas están cubiertas por el Seguro Integral de Salud (SIS), incluyendo los estudios realizados en el INEN para predisposición y diagnóstico de cáncer. Este centro especializado también brinda el servicio a los asegurados de EsSalud y pacientes de clínicas.
Desde el 2021, el INEN ofrece teleconsultas en el servicio de genética, permitiendo la atención de pacientes en provincias, facilitando el acceso a la evaluación genética inicial. Una vez determinada la necesidad de un estudio genético a través de la teleconsulta, se coordina la toma de muestra, que puede realizarse en el hospital de origen y ser enviada al INEN.
El tiempo de entrega de los resultados de los estudios genéticos puede variar significativamente dependiendo de la complejidad del estudio. Los más complejos, como los de predisposición al cáncer que utilizan NGS pueden tardar entre dos a tres meses debido a la alta demanda y la complejidad del análisis bioinformático y la elaboración del reporte final.
Finalmente, el doctor Yaser Sullcahuamán hace un llamado para tener una mayor conciencia y educación sobre la genética médica entre profesionales de la salud y la población, para evitar diagnósticos tardíos y garantizar que los pacientes se beneficien de estas herramientas.
Fuente: Agencia Andina